¿Encuentras que equilibrar la ecuación química es una tarea desalentadora? En caso afirmativo, también puede confundirse jugando con las moléculas y los átomos. Tienes que equilibrar la ecuación química pase lo que pase, según la Ley de Conservación de la Materia, pero a muchos estudiantes les resulta difícil equilibrarla. El equilibrio requiere mucha práctica, conocimiento de reacciones, fórmulas, cenefas, símbolos y técnicas. A menudo, los estudiantes pierden la esperanza y luchan por resolverlo. Si también tiene dificultades, entonces todo lo que necesita es una hoja de trabajo de equilibrio de ecuaciones con respuestas.
Comprender los métodos y los consejos puede facilitarle el equilibrio de la ecuación química. Cuando equilibra la ecuación, automáticamente establece una relación matemática entre productos y reactivos. Si a menudo se confunde al equilibrar las ecuaciones químicas, explore algunos entresijos y consejos para equilibrar la ecuación química en el artículo.
¿Qué es una ecuación química?
Una ecuación química es el símbolo en Química que representa una reacción química con la ayuda de fórmulas químicas. Contiene las sustancias químicas que intervienen en la reacción. Contiene reactivos y productos. Los reactivos son los elementos que reaccionan entre sí en una reacción química, mientras que los productos son los elementos que obtenemos tras la reacción.
La ecuación química tiene los productos en el lado derecho, mientras que los reactivos están escritos en el lado izquierdo. Ambos están separados por una flecha. Por ejemplo, 2H2 + O2 -> 2H20 indica que hay cuatro átomos de hidrógeno y 2 átomos de oxígeno en ambos lados de la ecuación. La cantidad de reactivos debe ser igual a la cantidad de productos. Cuando los estudiantes obtienen grandes ecuaciones químicas en una hoja de trabajo de equilibrio de ecuaciones, a menudo les resulta muy difícil. También lo ayudaremos a comprender a través de algunos consejos en este artículo, para ayudarlo a superar el proceso sin problemas.
Hojas de trabajo de equilibrio de ecuaciones químicas

#01

#02

#03

#04

#05

#06

#07

#08

#09

#10
¿Por qué es importante equilibrar las ecuaciones químicas?
Cuando está atascado en el equilibrio de ecuaciones químicas, a menudo puede preguntarse por qué lo está haciendo. Algunos estudiantes no se molestan y simplemente lo equilibran porque se les dice que lo hagan, pero algunos intentan ser lógicos y quieren saber la verdadera razón detrás de equilibrarlo. Es necesario equilibrarlo porque debe haber igual número de átomos en ambos lados de la ecuación. Además, debe estar equilibrado por ambos lados, debido a la Ley de Conservación de la Masa.
La ley establece que debe haber una cantidad igual de antes y después del experimento, asegurando que la cantidad y la calidad sigan siendo las mismas. Esta ley fue establecida por Antoine Laurent en 1789. Exploró que la materia no puede destruirse ni crearse. Además, las ecuaciones deben equilibrarse correctamente porque las ecuaciones desiguales no son ecuaciones correctas. No importa si tienen elementos y cantidades correctos, no se considerarán exactos. Además, estas ecuaciones no balanceadas no se pueden usar para calcular las reacciones químicas .
Además de esto, las ecuaciones químicas deben equilibrarse incluso porque los productos químicos no reaccionarán hasta que haya agregado las proporciones molares correctas. Además, la ecuación equilibrada es necesaria para determinar la cantidad de reactivo que necesitaría para fabricar el producto específico. Esto simplemente significa que no se formarán los productos correctos a menos que agregue la cantidad correcta de reactivos.
Algunos estudiantes realmente encuentran que las ecuaciones de equilibrio son difíciles en la hoja de cálculo de ecuaciones de equilibrio. Es difícil y puede requerir lucha, pero todo lo que necesita hacer es practicar, tener paciencia y tener buena memoria. Al principio, puede enfrentar dificultades, pero debe seguir trabajando duro y seguramente tendrá éxito. Explicaremos los consejos a continuación en nuestra sección adicional, pero aquí hay algunos breves. Necesita aprender reacciones y escribir fórmulas de reactivos. Comprende el concepto y equilibra la ecuación. Una vez que comprenda el concepto, se sorprenderá de lo fácil que le resultará el equilibrio. Puede parecer difícil de creer en este momento, pero sigue trabajando en esta ecuación, y de repente harán clic. Una vez que comprenda la lógica detrás de ellos, no habrá nada que lo detenga.
Hojas de trabajo de equilibrio de ecuaciones con respuestas

#11

#12

#13

#14

#15

#dieciséis

#17

#18

#19

#20
¿Cuáles son los diferentes tipos de ecuaciones químicas?
Antes de que lo ayudemos a comprender los consejos y trucos para equilibrar ecuaciones, primero debe conocer los tipos de ecuaciones químicas. Básicamente, hay cinco tipos de ecuaciones químicas y sus reacciones. Échales un vistazo a continuación.
Reacción química de combinación o síntesis
Este es el tipo más común de ecuación química. En esta ecuación química, se forma un nuevo producto al combinar dos o tres combinaciones de reactivos. Por ejemplo, H 2 + O 2 H 2 O. Esta es una ecuación química donde dos átomos de hidrógeno se combinan para formar un producto, agua. Es por eso que esta reacción se llama reacción de síntesis. Además, esta también es una ecuación desigual porque hay dos átomos presentes para el oxígeno en el lado del reactivo, mientras que solo hay un átomo en el lado del oxígeno para el producto. Pero la ecuación solo es válida cuando el número de átomos y moles es igual en ambos lados. Puede equilibrar la ecuación utilizando el método de combustión que se explicará más adelante.
Reacción química de descomposición
La reacción química de descomposición es la reacción en la que solo un compuesto se descompone y da como resultado dos o más de dos productos. Pb(No 3 ) 2 PbO + NO 2 + O 2 . En esta ecuación, se descompone el nitrato de plomo, que se descompone para formar dióxido de nitrógeno, oxígeno y óxido de plomo. Este es un ejemplo de una reacción de descomposición.
Reacción de desplazamiento o reemplazo
Otra reacción química muy común es de dos tipos, es decir, desplazamiento simple y desplazamiento doble. En una reacción de desplazamiento simple, cualquier socio químico intercambia de reactivos a productos, mientras que dos conjuntos de socios químicos intercambian de reactivos a productos. Un ejemplo de reacción de desplazamiento simple es XY + Z XZ + Y.
En este ejemplo, el zinc reemplazará al hidrógeno del ácido sulfúrico para formar sulfato de zinc. Como puede ver, aquí solo se intercambia un catión, lo que significa que es una reacción de desplazamiento simple. Continuando con el ejemplo similar, en la segunda ecuación química de desplazamiento, BaCl 2 + NaSO 4 BaSO 4 + 2NaCl sería la ecuación. En esta ecuación, el ion cloruro abandona el bario y se une al sodio.
Reacción de combustión
Esta es la reacción química donde un compuesto de oxígeno y un compuesto de carbono se combinan para convertirse en H 2 O y CO 2 . Es la reacción en la que principalmente un compuesto orgánico como el oxígeno se quema dando lugar a agua, dióxido de carbono o algún otro producto. La combinación de cualquier sustancia con oxígeno da como resultado la combustión.
Reacción ácido base
Esta es la reacción química simple donde el ácido y la base se combinan para proporcionar agua y sal. Esta reacción también se denomina reacción de neutralización y, más comúnmente, se denomina reacción ácido-base. Estos son tipos de reacciones realmente importantes que ocurren en los sistemas biológicos.
Hoja de trabajo de práctica de equilibrio de ecuaciones

#21

#22

#23

#24

#25

#26

#27

#28

#29
¿Cómo equilibrar una ecuación química?
Cuando los estudiantes a menudo se sienten frustrados, optan por equilibrar las respuestas de la hoja de trabajo de ecuaciones químicas para resolver el problema. Si también encuentra dificultades para equilibrar las ecuaciones químicas, siga los pasos a continuación.
Paso # 1: Escriba la ecuación desequilibrada
El primer paso para balancear la ecuación es escribir la fórmula química de los reactivos que se enumeran en el lado izquierdo de la ecuación química. Después de esto, puedes enumerar los productos en el lado derecho de la ecuación química. Hay una flecha entre los lados, que indica la dirección en la que se está produciendo la reacción. Una vez que haya recopilado los datos desequilibrados, le ayudará a equilibrar la ecuación.
Paso # 2: Equilibre la Ecuación
Ahora es el momento de aplicar la ley de conservación de la masa. Esta ley establece que el mismo número de átomos debe estar presente en ambos lados de la ecuación química. Una de las formas más fáciles de equilibrar la ecuación química es buscar un elemento que tenga solo un reactivo y un producto. Una vez que ese elemento está equilibrado, puede proceder a equilibrar el otro. De esta forma, podrás seguir moviéndote hacia los demás hasta que todos los elementos estén equilibrados.
Al colocar el coeficiente delante de ellos, puedes equilibrar las fórmulas químicas. A menudo, las personas se confunden y agregan subíndices, lo que cambia por completo la fórmula. Hay tres métodos básicos para equilibrar la ecuación química. Explicaremos cada uno de ellos a continuación en nuestra sección adicional. Puede cualquiera de los que buscan el tipo de ecuación química.
Paso #3: Indicando los Estados de la Materia
Por último, debe indicar los estados de la materia de los productos y reactivos. Puedes usar g para sustancias gaseosas. Puede usar l para líquidos y s para sólidos. Si encuentra especies en solución de agua, use aq para eso.

#30

#31

#32

#33

#34

#35

#36

#37

#38

#39

#41
Métodos que puede usar para equilibrar la ecuación química
Hay dos tipos diferentes de métodos que se usan comúnmente para equilibrar ecuaciones químicas. Échales un vistazo a continuación.
Método de reacción de combustión
Este es el tipo de método que se utiliza para equilibrar ecuaciones que tienen oxígeno en ambos lados. A menudo, estos son difíciles de equilibrar. Cuando encuentre dificultades para equilibrar la ecuación en la hoja de trabajo de equilibrio de ecuaciones químicas, puede fallar con una fracción de ½ y eso equilibrará fácilmente la ecuación. Pero el problema es que no puedes tener una fracción para el coeficiente, por eso duplicar todos los coeficientes te ayudará a equilibrar la ecuación.
Método de proporción
Este es el segundo tipo de método que se puede utilizar para equilibrar la ecuación. Se utiliza cuando la ecuación química es difícil de inspeccionar. Si no entiende la ecuación después de unos minutos, use el método de la proporción. Asegúrese de cambiar el valor del coeficiente y no del subíndice.
Consejos para equilibrar ecuaciones químicas
Si también se queda perplejo al equilibrar ecuaciones químicas, siga los consejos para obtener las respuestas correctas de la hoja de trabajo de equilibrio de ecuaciones químicas.
- Consejo #1: Cuando estés tratando de balancear las ecuaciones químicas, debes recordar que solo puedes cambiar el valor del coeficiente delante del elemento o compuesto, y no el subíndice.
- Consejo #2: Debes recordar que los iones poliatómicos deben equilibrarse como un todo. Por ejemplo, el SO 4 debe equilibrarse como un todo en lugar de oxígeno y azufre por separado.
- Consejo # 3: Debe recordar equilibrar primero el número que tiene la mayor cantidad de átomos en cualquier producto o reactivo. Asegúrese de que estos elementos no sean oxígeno ni hidrógeno.
- Consejo #4: Debes contar el número de átomos de cada elemento en ambos lados y ver si la ecuación está balanceada o no.
- Consejo n.° 5: cuando equilibre con éxito la ecuación, asegúrese de verificar el coeficiente. Debe estar en su término más bajo.
Limitaciones de la ecuación química
Existen ciertas limitaciones para las ecuaciones químicas enumeradas a continuación.
- Hay algunas ecuaciones químicas que no aclaran el estado de las sustancias. Por lo tanto, puede agregar g para gas, l para líquido, s para sólido y vap para vapor.
- La ecuación química no da ninguna información sobre la velocidad de reacción.
- A veces, la ecuación química tampoco da la concentración de las sustancias, por eso se usan términos como concentrado y diluido.
- La ecuación química no dirá si el producto final cambiaría de color o se decoloraría. Por eso hay que mencionarlo por separado.
- La ecuación química tampoco da ninguna información sobre la velocidad de la reacción.
- Algunas ecuaciones y reacciones químicas tienen diversos efectos.
Pensamiento final
Es probable que los estudiantes encuentren dificultades para equilibrar la hoja de trabajo de ecuaciones químicas. Para ayudarlo a resolver este problema, tenemos una hoja de cálculo de equilibrio de ecuaciones con respuestas en nuestro sitio web principal. Simplemente puede descargarlo y cotejar sus ecuaciones químicas. Practica para tu examen usando estas hojas de trabajo y da lo mejor de ti. ¡Buena suerte!

#42

#43

#44

#45

#46

#47
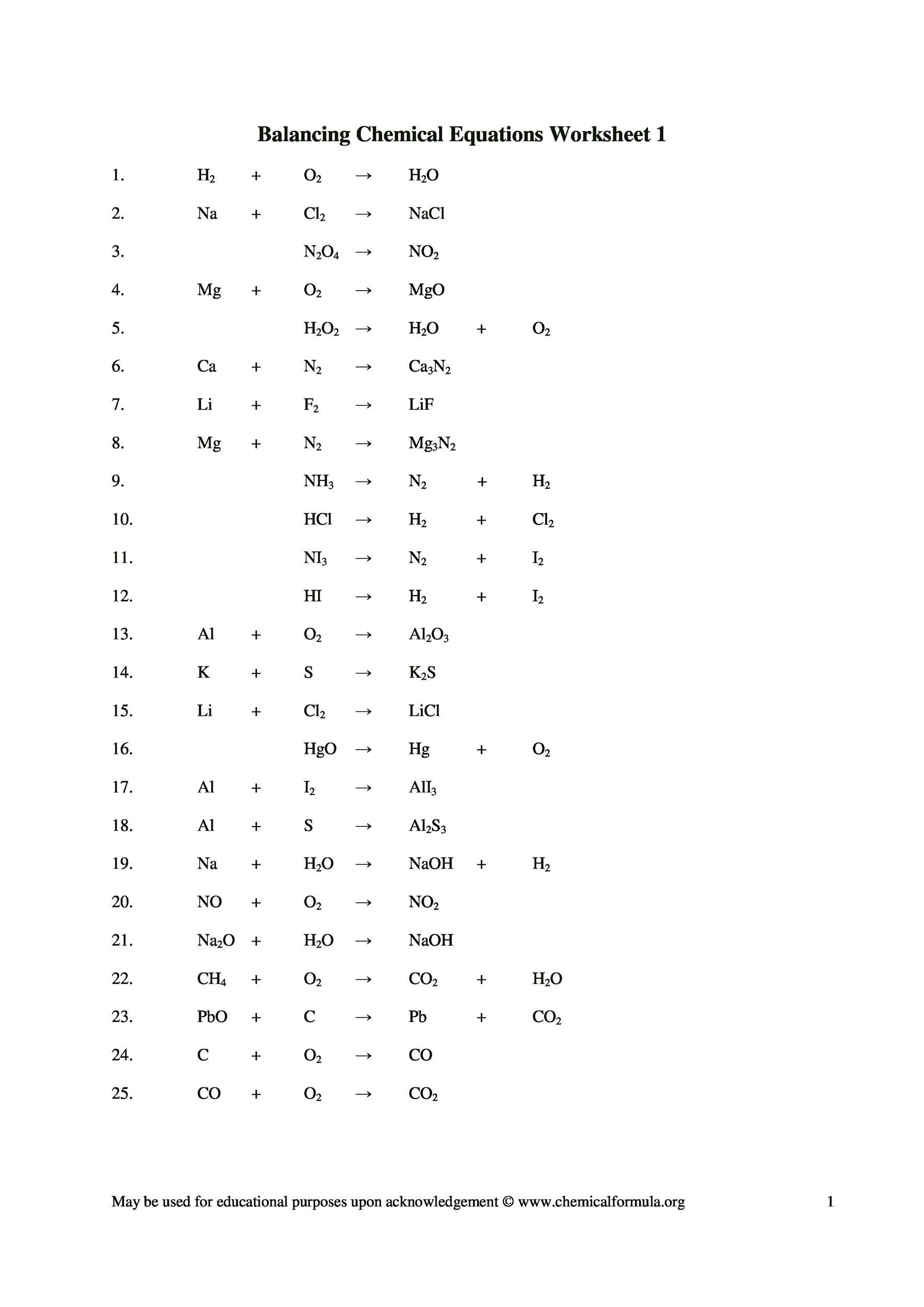
#48

#49
